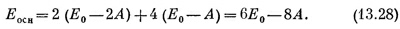Главная >> Фейнмановские лекции по физике >> Том 9 >> Глава 13. Приближение независимых частиц Молекула бензола
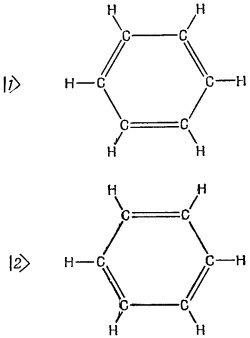 Хотя квантовая механика снабжает нас основными законами, определяющими строение молекул, эти законы, однако, удается точно применить лишь к самым простым соединениям. Поэтому химики разработали различные приближенные способы расчета некоторых из свойств сложных молекул. Мы хотим здесь рассказать, как химики-органики применяют приближение независимых частиц. Начнем с молекулы бензола. Мы ее рассматривали с другой точки зрения в гл. 8 (вып. 8). Тогда мы воспользовались приближенным представлением молекулы в виде системы с двумя состояниями, базисные состояния которой показаны на фиг. 13.3. Имеется кольцо из шести углеродов, к каждому из которых приделано по водороду. По принятой схеме валентных связей необходимо допустить, что между половиной атомов углерода имеются двойные связи и что в низших энергетических условиях возникают две возможности, показанные на рисунке. Но, кроме этого, имеются и еще другие, более высокоэнергетические состояния. Когда мы в гл. 8 говорили о молекуле бензола, мы пользовались только двумя состояпиями, а прочие забыли. И мы обнаружили, что энергия основного состояния молекулы не совпадала с энергией ни одного из нарисованных состояний; нет, она была ниже на величину, пропорциональную амплитуде переброса из одного такого состояния в другое. Хотя квантовая механика снабжает нас основными законами, определяющими строение молекул, эти законы, однако, удается точно применить лишь к самым простым соединениям. Поэтому химики разработали различные приближенные способы расчета некоторых из свойств сложных молекул. Мы хотим здесь рассказать, как химики-органики применяют приближение независимых частиц. Начнем с молекулы бензола. Мы ее рассматривали с другой точки зрения в гл. 8 (вып. 8). Тогда мы воспользовались приближенным представлением молекулы в виде системы с двумя состояниями, базисные состояния которой показаны на фиг. 13.3. Имеется кольцо из шести углеродов, к каждому из которых приделано по водороду. По принятой схеме валентных связей необходимо допустить, что между половиной атомов углерода имеются двойные связи и что в низших энергетических условиях возникают две возможности, показанные на рисунке. Но, кроме этого, имеются и еще другие, более высокоэнергетические состояния. Когда мы в гл. 8 говорили о молекуле бензола, мы пользовались только двумя состояпиями, а прочие забыли. И мы обнаружили, что энергия основного состояния молекулы не совпадала с энергией ни одного из нарисованных состояний; нет, она была ниже на величину, пропорциональную амплитуде переброса из одного такого состояния в другое.
А теперь мы хотим взглянуть на ту же молекулу с совершенно иной точки зрения, применяя приближение другого рода. Обе точки зрения приведут нас к разным ответам, но когда мы усовершенствуем оба приближения, то придем к истине — к правильному описанию бензола.
Однако если не позаботиться об этих усовершенствованиях (что обычно и делают), то не нужно удивляться, что эти описания не сойдутся. Мы по крайней мере покажем, что при новой точке зрения низшая энергия молекулы бензола оказывается ниже, чем у любой из структур с тремя двойными связями (см. фиг. 13.3).
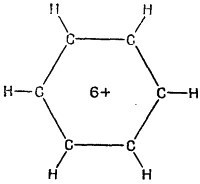 Рассмотрим следующую картину. Представим себе шесть атомов водорода, связанных только одиночными связями (фиг. 13.4). Мы убрали шесть электронов (поскольку каждая связь обозначает пару электронов), так что перед нами шестикратно ионизованная молекула бензола. Теперь посмотрим, что случится, когда мы поодиночке вернем в молекулу всю шестерку электронов, считая, что каждый из них может свободно двигаться вокруг кольца. Допустим также, что все связи, показанные на фиг. 13.4, заполнены и не нуждаются в дальнейшем рассмотрении. Что происходит, когда мы возвращаем молекулярному иону его электрон? Он, конечно, может расположиться в любом из шести мест на кольце, соответствующих шести базисным состояниям. И у него будет некоторая амплитуда (скажем А) того, что он перейдет с одного места на другое. При анализе стационарных состояний обнаружатся несколько возможных уровней энергии. Это только при одном электроне. Рассмотрим следующую картину. Представим себе шесть атомов водорода, связанных только одиночными связями (фиг. 13.4). Мы убрали шесть электронов (поскольку каждая связь обозначает пару электронов), так что перед нами шестикратно ионизованная молекула бензола. Теперь посмотрим, что случится, когда мы поодиночке вернем в молекулу всю шестерку электронов, считая, что каждый из них может свободно двигаться вокруг кольца. Допустим также, что все связи, показанные на фиг. 13.4, заполнены и не нуждаются в дальнейшем рассмотрении. Что происходит, когда мы возвращаем молекулярному иону его электрон? Он, конечно, может расположиться в любом из шести мест на кольце, соответствующих шести базисным состояниям. И у него будет некоторая амплитуда (скажем А) того, что он перейдет с одного места на другое. При анализе стационарных состояний обнаружатся несколько возможных уровней энергии. Это только при одном электроне.
Добавим еще один электрон. И сделаем теперь самое странное предположение: то, что делает один электрон, не сказывается на том, что делает другой. На самом деле они, конечно, будут взаимодействовать; они отталкивают друг друга с помощью кулоновых сил, и, кроме того, их энергия, когда они попадают в одно место, должна заметно отличаться от удвоенной энергии, когда они туда попадают поодиночке. Конечно, приближение независимых частиц незаконно, когда мест только шесть, особенно когда в них хотят поместить шестерку электронов. Но, несмотря на это, химики-органики сумели многому научиться, делая именно такое приближение.
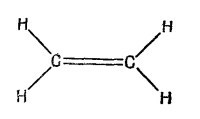 Прежде чем подробно рассчитывать молекулу бензола, возьмем пример попроще — молекулу этилена. В нее входят только два атома углерода и по паре атомов водорода с каждой стороны (фиг. 13.5). Прежде чем подробно рассчитывать молекулу бензола, возьмем пример попроще — молекулу этилена. В нее входят только два атома углерода и по паре атомов водорода с каждой стороны (фиг. 13.5).
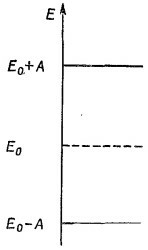 У молекулы есть одна «лишняя» связь между двумя атомами углерода, в которую входят два электрона. Уберем один из этих электронов; что мы получим? То, что останется, можно будет рассматривать как систему с двумя состояниями: оставшийся электрон может находиться либо возле одного атома, либо возле другого. И, как у всякой системы с двумя состояниями, допустимые энергии отдельного электрона могут быть равны либо Е0 — А, либо Ео+А (фиг. 13.6). У молекулы есть одна «лишняя» связь между двумя атомами углерода, в которую входят два электрона. Уберем один из этих электронов; что мы получим? То, что останется, можно будет рассматривать как систему с двумя состояниями: оставшийся электрон может находиться либо возле одного атома, либо возле другого. И, как у всякой системы с двумя состояниями, допустимые энергии отдельного электрона могут быть равны либо Е0 — А, либо Ео+А (фиг. 13.6).
Добавим теперь второй электрон. Все очень хорошо: электронов у нас два — первый можно поставить в нижнее состояние, а второй в верхнее, не так ли? Не совсем, — Ео мы о чем-то забыли. Ведь каждое из состояний на самом деле двойное. Когда мы говорим, что допустимо состояние с энергией Е0—А, то в действительности там их пара. В одно и тоже состояние могут попасть два электрона, один со спином, направленным вверх, другой —вниз (но не больше, из-за принципа запрета). Так что на самом деле имеются два возможных состояния с энергией Е0 — А.
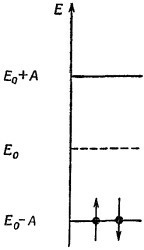 Можно начертить диаграмму (фиг. 13.7), которая показывает и уровни энергии, и их населенность. В состоянии наименьшей энергии оба электрона будут в наинизшем состоянии с противоположными спинами. Энергия «лишней» связи в молекуле этилена поэтому равна 2(Е0 — А), если пренебречь взаимодействием между двумя электронами. Можно начертить диаграмму (фиг. 13.7), которая показывает и уровни энергии, и их населенность. В состоянии наименьшей энергии оба электрона будут в наинизшем состоянии с противоположными спинами. Энергия «лишней» связи в молекуле этилена поэтому равна 2(Е0 — А), если пренебречь взаимодействием между двумя электронами.
Теперь вернемся к бензолу. У каждого из двух состояний на фиг. 13.3 есть три двойные связи. И каждая из них очень похожа на связь в этилене и дает вклад в энергию 2 (Е0 — А), где теперь Е0 — уже энергия, необходимая, чтобы поместить электрон в бензоле на нужное место, a A — амплитуда переброса его в соседнее место. Значит, энергия должна быть равна примерно 6 (Е0 — А). Но когда мы раньше изучали бензол, то пришли к выводу, что его энергия ниже энергии структуры с тремя двойными связями. Посмотрим, получится ли теперь, с нашей новой точки зрения, энергия бензола ниже, чем у трех двойных связей.
Начинаем с шестикратно ионизованного бензольного кольца. Добавляем один электрон. Теперь у нас система с шестью состояниями. Мы пока еще не решали таких систем, но знаем, что нужно делать. Можно написать шесть уравнений для шести амплитуд и т. д. Но не лучше ли сберечь свои силы, ведь мы уже решили эту задачу, исследуя электрон в бесконечной цепочке атомов. Конечно, бензол — не бесконечная цепочка, шесть мест для атомов в нем расположены по кругу. Но представьте, что мы разняли кольцо в цепь и пронумеровали атомы вдоль цепи числами от 1 до 6. В бесконечной линии следующее место имело бы номер 7, но если мы условимся, что оно совпадает с местом номер 1 и т. д., то все окажется в точности похожим на бензольное кольцо. Иными словами, мы можем взять решение для бесконечной линии с добавочным требованием, чтобы решение было периодичным с периодом длиной в шесть атомов. Согласно гл. 11, электрон на прямой обладает состояниями определенной энергии, когда амплитуда того, что он окажется в некотором месте хn, равна eikxn = e¡kbn. При каждом k энергия равна
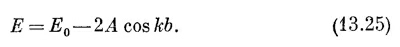 |
Теперь из этих решений нам нужно оставить только такие, которые через каждые 6 атомов повторяются. Разберем сперва общий случай, когда в кольце N атомов. Если решение должно иметь период в N атомных расстояний, то eikbN должна быть равна единице, или kbN должна быть кратна 2π. Если s — любое целое число, то наше условие имеет вид
Мы раньше видели, что нет смысла брать k вне пределов ± π/b. Это означает, что мы получим все мыслимые состояния, беря значения s в пределах ±N/2.
Стало быть, мы приходим к тому, что у N-атомного кольца имеется N состояний определенной энергии и их волновые числа ks даются числами
 |
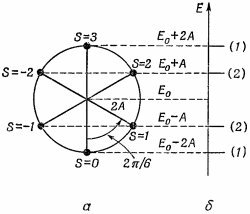 Каждое состояние имеет энергию (13.25). Получается линейчатый спектр возможных уровней энергий. Спектр для бензола (N=6) показан на фиг. 13.8, б. (Числа в скобках указывают число различных состояний с одинаковой энергией.) Каждое состояние имеет энергию (13.25). Получается линейчатый спектр возможных уровней энергий. Спектр для бензола (N=6) показан на фиг. 13.8, б. (Числа в скобках указывают число различных состояний с одинаковой энергией.)
Есть наглядный способ изобразить эти шесть уровней энергии. Он показан на фиг. 13.8, а. Вообразим круг с центром на одном уровне с Е0 и с радиусом 2А. Если мы отложим, начиная снизу, шесть равных дуг (под углами, считая от нижней точки, ksb = 2πs/N, или 2πs/6 для бензола), то высоты точек круга будут решениями (13.25). Шесть точек представляют шесть возможных состояний. Низший уровень энергии придется на Е0 — 2А; дальше идут два состояния с одинаковой энергией Е0 — A и т. д. Это возможные состояния одного электрона. Если электронов не один, а больше, то в каждое состояние может попасть по два электрона с противоположными спинами.
У молекулы бензола надо здесь разместить шесть электронов. Если состояние основное, то они должны попасть в наинизшие возможные энергетические состояния — пара в s = 0, пара в s = +1 и пара в s = —1. Согласно приближению независимых частиц, энергия основного состояния равна
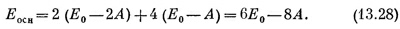 |
Она действительно оказывается меньше, чем у трех отдельных двойных связей,— на 2А.
Сравнив энергию бензола с энергией этилена, можно определить А. Эта величина оказывается равной 0,8 эв, или в единицах, которые нравятся химикам, 18 ккал/молъ.
Этим описанием можно воспользоваться, чтобы вычислить или понять другие свойства бензола. Например, глядя на фиг. 13.8, можно разобраться в возбуждении бензола светом. Что бы произошло, если бы мы попытались возбудить один из электронов? Он мог бы передвинуться к одному из незанятых высших состояний. Наинизшей энергией возбуждения оказался бы переход от наивысшего заполненного уровня к наинизшему пустому. Эта энергия равна 2А. Бензол будет поглощать свет с частотой v = 2A/h. Кроме того, будет наблюдаться также поглощение фотонов с энергиями 3А и 4А. Нечего и говорить, что спектр поглощения бензола был измерен, и картина спектральных линий оказалась более или менее правильной, если не считать того, что наинизшие переходы наблюдаются в ультрафиолете; и чтобы удовлетворить всем данным, пришлось бы взять величину А около 1,4—2,4 эв. Иначе говоря, численное значение А вдвое-втрое выше, чем предсказывается энергией химической связи.
Как же поступает химик в таких случаях? Он анализирует множество молекул сходного типа и выводит какие-то эмпирические правила. Он учит, например: для расчета энергии связи берите вот такое-то и такое-то значение А, а для получения приближенно верного спектра поглощения возьмите другое значение А. Вам может показаться, что это звучит слегка абсурдно. И впрямь, в ушах физика, который пытается объяснить всю природу из первоначальных принципов, это звучит довольно дико. Но перед химиком задача другая. Он обязан заранее догадаться, что произойдет с молекулами, которых до сих пор не было или которые до конца не поняты. Ему нужен ряд эмпирических правил и ему совершенно все равно, откуда они возьмутся. Так что теорией он пользуется совсем не так, как физик. Он берет уравнения, в которых отразился свет истины, а потом вынужден менять в них константы, делая эмпирические поправки.
В случае бензола основная причина несогласия лежит в нашем предположении, что электроны независимы; теория, из которой мы исходили, на самом деле незаконна. Тем не менее на нее падает какой-то отблеск истины, потому что результаты, по-видимому, идут в правильном направлении. При помощи таких уравнений плюс некоторые эмпирические правила (со множеством исключений) химик-органик прокладывает свой путь через чащу тех сложнейших вещей, которые он решился изучать. (Не забывайте, что в действительности причина, по которой физику удается выводить что-то из основных принципов, состоит в том, что он выбирает только простые задачи. Он никогда не решает задач с 42 или даже с 6 электронами. До сих пор он смог рассчитать с приличной точностью только атом водорода да атом гелия.)
СМОТРИТЕ ТАКЖЕ:
Социальные комментарии Cackle
|




 Хотя квантовая механика снабжает нас основными законами, определяющими строение молекул, эти законы, однако, удается точно применить лишь к самым простым соединениям. Поэтому химики разработали различные приближенные способы расчета некоторых из свойств сложных молекул. Мы хотим здесь рассказать, как химики-органики применяют приближение независимых частиц. Начнем с молекулы бензола. Мы ее рассматривали с другой точки зрения в гл. 8 (вып. 8). Тогда мы воспользовались приближенным представлением молекулы в виде системы с двумя состояниями, базисные состояния которой показаны на фиг. 13.3. Имеется кольцо из шести углеродов, к каждому из которых приделано по водороду. По принятой схеме валентных связей необходимо допустить, что между половиной атомов углерода имеются двойные связи и что в низших энергетических условиях возникают две возможности, показанные на рисунке. Но, кроме этого, имеются и еще другие, более высокоэнергетические состояния. Когда мы в гл. 8 говорили о молекуле бензола, мы пользовались только двумя состояпиями, а прочие забыли. И мы обнаружили, что энергия основного состояния молекулы не совпадала с энергией ни одного из нарисованных состояний; нет, она была ниже на величину, пропорциональную амплитуде переброса из одного такого состояния в другое.
Хотя квантовая механика снабжает нас основными законами, определяющими строение молекул, эти законы, однако, удается точно применить лишь к самым простым соединениям. Поэтому химики разработали различные приближенные способы расчета некоторых из свойств сложных молекул. Мы хотим здесь рассказать, как химики-органики применяют приближение независимых частиц. Начнем с молекулы бензола. Мы ее рассматривали с другой точки зрения в гл. 8 (вып. 8). Тогда мы воспользовались приближенным представлением молекулы в виде системы с двумя состояниями, базисные состояния которой показаны на фиг. 13.3. Имеется кольцо из шести углеродов, к каждому из которых приделано по водороду. По принятой схеме валентных связей необходимо допустить, что между половиной атомов углерода имеются двойные связи и что в низших энергетических условиях возникают две возможности, показанные на рисунке. Но, кроме этого, имеются и еще другие, более высокоэнергетические состояния. Когда мы в гл. 8 говорили о молекуле бензола, мы пользовались только двумя состояпиями, а прочие забыли. И мы обнаружили, что энергия основного состояния молекулы не совпадала с энергией ни одного из нарисованных состояний; нет, она была ниже на величину, пропорциональную амплитуде переброса из одного такого состояния в другое. Рассмотрим следующую картину. Представим себе шесть атомов водорода, связанных только одиночными связями (фиг. 13.4). Мы убрали шесть электронов (поскольку каждая связь обозначает пару электронов), так что перед нами шестикратно ионизованная молекула бензола. Теперь посмотрим, что случится, когда мы поодиночке вернем в молекулу всю шестерку электронов, считая, что каждый из них может свободно двигаться вокруг кольца. Допустим также, что все связи, показанные на фиг. 13.4, заполнены и не нуждаются в дальнейшем рассмотрении. Что происходит, когда мы возвращаем молекулярному иону его электрон? Он, конечно, может расположиться в любом из шести мест на кольце, соответствующих шести базисным состояниям. И у него будет некоторая амплитуда (скажем А) того, что он перейдет с одного места на другое. При анализе стационарных состояний обнаружатся несколько возможных уровней энергии. Это только при одном электроне.
Рассмотрим следующую картину. Представим себе шесть атомов водорода, связанных только одиночными связями (фиг. 13.4). Мы убрали шесть электронов (поскольку каждая связь обозначает пару электронов), так что перед нами шестикратно ионизованная молекула бензола. Теперь посмотрим, что случится, когда мы поодиночке вернем в молекулу всю шестерку электронов, считая, что каждый из них может свободно двигаться вокруг кольца. Допустим также, что все связи, показанные на фиг. 13.4, заполнены и не нуждаются в дальнейшем рассмотрении. Что происходит, когда мы возвращаем молекулярному иону его электрон? Он, конечно, может расположиться в любом из шести мест на кольце, соответствующих шести базисным состояниям. И у него будет некоторая амплитуда (скажем А) того, что он перейдет с одного места на другое. При анализе стационарных состояний обнаружатся несколько возможных уровней энергии. Это только при одном электроне. Прежде чем подробно рассчитывать молекулу бензола, возьмем пример попроще — молекулу этилена. В нее входят только два атома углерода и по паре атомов водорода с каждой стороны (фиг. 13.5).
Прежде чем подробно рассчитывать молекулу бензола, возьмем пример попроще — молекулу этилена. В нее входят только два атома углерода и по паре атомов водорода с каждой стороны (фиг. 13.5). У молекулы есть одна «лишняя» связь между двумя атомами углерода, в которую входят два электрона. Уберем один из этих электронов; что мы получим? То, что останется, можно будет рассматривать как систему с двумя состояниями: оставшийся электрон может находиться либо возле одного атома, либо возле другого. И, как у всякой системы с двумя состояниями, допустимые энергии отдельного электрона могут быть равны либо Е0 — А, либо Ео+А (фиг. 13.6).
У молекулы есть одна «лишняя» связь между двумя атомами углерода, в которую входят два электрона. Уберем один из этих электронов; что мы получим? То, что останется, можно будет рассматривать как систему с двумя состояниями: оставшийся электрон может находиться либо возле одного атома, либо возле другого. И, как у всякой системы с двумя состояниями, допустимые энергии отдельного электрона могут быть равны либо Е0 — А, либо Ео+А (фиг. 13.6). Можно начертить диаграмму (фиг. 13.7), которая показывает и уровни энергии, и их населенность. В состоянии наименьшей энергии оба электрона будут в наинизшем состоянии с противоположными спинами. Энергия «лишней» связи в молекуле этилена поэтому равна 2(Е0 — А), если пренебречь взаимодействием между двумя электронами.
Можно начертить диаграмму (фиг. 13.7), которая показывает и уровни энергии, и их населенность. В состоянии наименьшей энергии оба электрона будут в наинизшем состоянии с противоположными спинами. Энергия «лишней» связи в молекуле этилена поэтому равна 2(Е0 — А), если пренебречь взаимодействием между двумя электронами.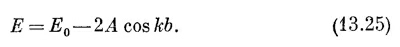


 Каждое состояние имеет энергию (13.25). Получается линейчатый спектр возможных уровней энергий. Спектр для бензола (N=6) показан на фиг. 13.8, б. (Числа в скобках указывают число различных состояний с одинаковой энергией.)
Каждое состояние имеет энергию (13.25). Получается линейчатый спектр возможных уровней энергий. Спектр для бензола (N=6) показан на фиг. 13.8, б. (Числа в скобках указывают число различных состояний с одинаковой энергией.)