Главная >> Фейнмановские лекции по физике >> Том 9 >> Глава 13. Приближение независимых частиц Еще немного органической химии
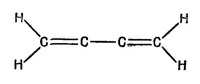 Можно ли применить все эти идеи для изучения других молекул? Рассмотрим такую молекулу, как бутадиен (1,3); она показана на фиг. 13.9 с помощью обычной картины валентных связей. Можно ли применить все эти идеи для изучения других молекул? Рассмотрим такую молекулу, как бутадиен (1,3); она показана на фиг. 13.9 с помощью обычной картины валентных связей.
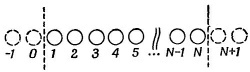 Мы можем опять затеять то же игры с лишней четверкой электронов, отвечающей двум двойным связям. Если ее убрать, то остается четыре атома углерода по одной линии. А как рассчитывать такую линию, вы уже знаете. «Но позвольте,— скажете вы,—я ведь только знаю, как решать бесконечную линию». Однако решения для бесконечной линии включают также и решения для конечной. Следите. Пусть N — число атомов на прямой; пронумеруем их 1, 2, ..., N (фиг. 13.10). В уравнении для амплитуды в точке 1 у вас не появится член для перехода из точки 0. Точно так же уравнение для точки N будет отличаться от того, которым мы пользовались для бесконечной прямой, потому что никакого вклада точки N + 1 не будет. Но представьте, что мы придумали решение для бесконечной прямой со следующим свойством: амплитуда оказаться вблизи атома 0 есть нуль и амплитуда оказаться вблизи атома N + 1 тоже нуль. Тогда система уравнений для всех точек от 1 до N на конечной линии также будет удовлетворяться. Казалось бы, таких решений не бывает, ибо все наши решения имеют вид е¡kxn и обладают всюду одинаковой абсолютной величиной. Но вспомните, что энергия зависит только от абсолютной величины k, так что другим в равной мере законным решением было бы е–¡kxn. И то же справедливо для любой суперпозиции этих двух решений. Вычитая их, мы получим решение sin kхn, а оно удовлетворяет требованию, чтобы амплитуда при х = 0 была нулем. И оно все еще соответствует энергии Е0 — 2А cos kb. Далее, подходящим выбором величины k можно также добиться, чтобы амплитуда в xN+1 была тоже нулем. Для этого нужно, чтобы (N + 1) кb было кратным π, т. е. чтобы Мы можем опять затеять то же игры с лишней четверкой электронов, отвечающей двум двойным связям. Если ее убрать, то остается четыре атома углерода по одной линии. А как рассчитывать такую линию, вы уже знаете. «Но позвольте,— скажете вы,—я ведь только знаю, как решать бесконечную линию». Однако решения для бесконечной линии включают также и решения для конечной. Следите. Пусть N — число атомов на прямой; пронумеруем их 1, 2, ..., N (фиг. 13.10). В уравнении для амплитуды в точке 1 у вас не появится член для перехода из точки 0. Точно так же уравнение для точки N будет отличаться от того, которым мы пользовались для бесконечной прямой, потому что никакого вклада точки N + 1 не будет. Но представьте, что мы придумали решение для бесконечной прямой со следующим свойством: амплитуда оказаться вблизи атома 0 есть нуль и амплитуда оказаться вблизи атома N + 1 тоже нуль. Тогда система уравнений для всех точек от 1 до N на конечной линии также будет удовлетворяться. Казалось бы, таких решений не бывает, ибо все наши решения имеют вид е¡kxn и обладают всюду одинаковой абсолютной величиной. Но вспомните, что энергия зависит только от абсолютной величины k, так что другим в равной мере законным решением было бы е–¡kxn. И то же справедливо для любой суперпозиции этих двух решений. Вычитая их, мы получим решение sin kхn, а оно удовлетворяет требованию, чтобы амплитуда при х = 0 была нулем. И оно все еще соответствует энергии Е0 — 2А cos kb. Далее, подходящим выбором величины k можно также добиться, чтобы амплитуда в xN+1 была тоже нулем. Для этого нужно, чтобы (N + 1) кb было кратным π, т. е. чтобы
 |
где s — целое число между 1 и N. (Берутся только положительные k, потому что каждое решение содержит и +k и – k; перемена знака k опять дает то же состояние.) Для молекулы бутадиена N = 4, так что имеется четверка состояний с
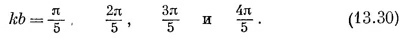 |
Уровни энергии можно теперь представить, пользуясь круговой диаграммой, похожей на бензольную. На сей раз возьмем полукруг, деленный на пять равных частей (фиг. 13.11). Точка внизу отвечает s = 0, что не дает какого-либо состояния. То же самое справедливо для точки наверху, отвечающей s = N + 1. Оставшиеся четыре точки дают четверку разрешенных энергий. Имеется четыре стационарных состояния, чего и следовало ожидать, судя по четырем базисным состояниям. В круговой диаграмме углы равны π/5, или 36°. Наинизшая энергия оказывается равной Е0 — 1,618A. (Каких только чудес не бывает в математике! Золотое сечение греков дает нам наинизшее энергетическое состояние молекулы бутадиена, как это следует из нашей теории!)
Теперь уже ясно, как меняется энергия молекулы бутадиена, когда в нее вводят четверку электронов. Эта четверка заполнит два нижних уровня — каждый будет заполнен парой электронов с противоположными спинами. Полная энергия будет равна
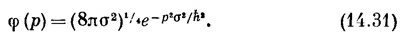 |
 Это выглядит вполне разумно. Энергия чуть пониже, чем просто у двух двойных связей, но связь не так сильна, как в бензоле. Во всяком случав, именно так химик анализирует некоторые органические молекулы. Это выглядит вполне разумно. Энергия чуть пониже, чем просто у двух двойных связей, но связь не так сильна, как в бензоле. Во всяком случав, именно так химик анализирует некоторые органические молекулы.
Но в его распоряжении есть не только энергии, но и амплитуды вероятности. Зная амплитуды для каждого состояния и зная, какие состояния заполнены, он может сообщить нам, какова вероятность нахождения электрона в каком-нибудь месте молекулы. Те места, где пребывание электрона более вероятно, вступают в игру при таких химических замещениях, которые требуют, чтобы электрон обслуживал и другую группу атомов. Другие же места молекулы участвуют в таких замещениях, при которых молекула имеет тенденцию передать системе еще один электрон.
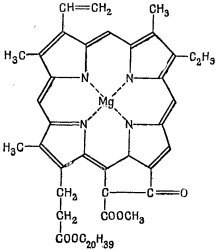
Подобные же идеи могут помочь нам получить правильное представление даже о таких сложных молекулах, как хлорофилл, один из вариантов которого показан на фиг. 13.12. Обратите внимание, что двойные и одиночные связи образуют длинное замкнутое кольцо с двадцатью интервалами.
Лишние электроны двойных связей могут бегать по этому кольцу. При помощи метода независимых частиц можно получить всю совокупность энергетических уровней. От переходов между этими уровнями возникают сильные линии поглощения, которые лежат в видимой части спектра и придают этой молекуле ее густой цвет. И другие сложные молекулы, такие, как ксантофилл, от которого листья получают красную окраску, можно изучить таким же точно способом.
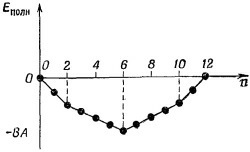 В органической химии при работе с подобного рода теорией используют еще одну идею. Она, пожалуй, самая удачная из всех (или по крайней мере в определенном смысле самая точная). Она отвечает на такой вопрос: в каких случаях получается особенно прочная химическая связь? Ответ очень интересен. Возьмем вначале для примера бензол и представим ряд событий, которые произойдут, если мы начнем с шестикратно ионизованной молекулы и примемся добавлять новые и новые электроны. Тогда нужно будет говорить о различных ионах бензола — отрицательных и положительных. Изобразим энергию иона (или нейтральной молекулы) как функцию числа электронов. Если мы примем Е0 = 0 (мы не знаем, чему равно Е0), то получим кривую, показанную на фиг. 13.13. Для первых двух электронов наклон функции постоянен — это прямая линия. Затем для каждой очередной группы электронов он возрастает, меняясь скачком от одной группы к другой. Наклон изменяется тогда, когда заканчивается заполнение системы уровней с одной энергией и очередному электрону приходится переходить к очередной более высокой системе уровней. В органической химии при работе с подобного рода теорией используют еще одну идею. Она, пожалуй, самая удачная из всех (или по крайней мере в определенном смысле самая точная). Она отвечает на такой вопрос: в каких случаях получается особенно прочная химическая связь? Ответ очень интересен. Возьмем вначале для примера бензол и представим ряд событий, которые произойдут, если мы начнем с шестикратно ионизованной молекулы и примемся добавлять новые и новые электроны. Тогда нужно будет говорить о различных ионах бензола — отрицательных и положительных. Изобразим энергию иона (или нейтральной молекулы) как функцию числа электронов. Если мы примем Е0 = 0 (мы не знаем, чему равно Е0), то получим кривую, показанную на фиг. 13.13. Для первых двух электронов наклон функции постоянен — это прямая линия. Затем для каждой очередной группы электронов он возрастает, меняясь скачком от одной группы к другой. Наклон изменяется тогда, когда заканчивается заполнение системы уровней с одной энергией и очередному электрону приходится переходить к очередной более высокой системе уровней.
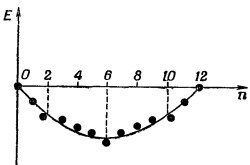 В действительности истинная энергия иона бензола совершенно непохожа на фиг. 13.13 из-за взаимодействий электронов и из-за электростатических энергий, которыми мы пренебрегли. Эти поправки, однако,.меняются с n довольно плавно. Даже если бы их все учесть, на окончательной энергетической кривой все равно остались бы изломы при таких n, при которых как раз заполняются отдельные уровни энергии. В действительности истинная энергия иона бензола совершенно непохожа на фиг. 13.13 из-за взаимодействий электронов и из-за электростатических энергий, которыми мы пренебрегли. Эти поправки, однако,.меняются с n довольно плавно. Даже если бы их все учесть, на окончательной энергетической кривой все равно остались бы изломы при таких n, при которых как раз заполняются отдельные уровни энергии.
Рассмотрим теперь очень гладкую кривую, на которой в среднем укладываются все точки (фиг. 13.14). Можно сказать, что точки над этой кривой обладают энергией «выше чем нормальной», а точки под нею «ниже чем нормальной». И в общем случае следует ожидать, что у конфигураций с «ниже чем нормальной» энергией средняя устойчивость окажется повышенной. Обратите внимание, что конфигурации, которые значительно ниже кривой, всегда оказываются в конце одного из прямолинейных отрезков, а именно там, где электронов как раз хватает на то, чтобы заполнить «энергетическую оболочку», как ее называют. Это очень точное предсказание теории. Молекулы и ионы особо устойчивы (по сравнению с прочими подобными конфигурациями), когда имеющиеся у них в наличии электроны как раз заполняют энергетическую оболочку.
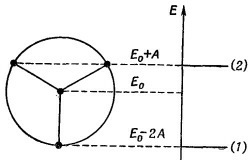 Эта теория объяснила и предсказала некоторые весьма необычные химические факты. Вот очень простой пример. Возьмем кольцо из трех атомов. Почти невозможно поверить, что химик сможет из трех атомов составить кольцо и сделать его устойчивым. Но это было сделано. Энергетический круг для трех электронов показан на фиг. 13.15. Если поместить в нижнее состояние два электрона, то пойдут в дело только два из трех требуемых электронов. Третий электрон придется поместить на более высокий уровень. Отсюда следует, что молекула не будет слишком устойчивой. Зато двухэлектронная структура обязана быть устойчивой. Эта теория объяснила и предсказала некоторые весьма необычные химические факты. Вот очень простой пример. Возьмем кольцо из трех атомов. Почти невозможно поверить, что химик сможет из трех атомов составить кольцо и сделать его устойчивым. Но это было сделано. Энергетический круг для трех электронов показан на фиг. 13.15. Если поместить в нижнее состояние два электрона, то пойдут в дело только два из трех требуемых электронов. Третий электрон придется поместить на более высокий уровень. Отсюда следует, что молекула не будет слишком устойчивой. Зато двухэлектронная структура обязана быть устойчивой.
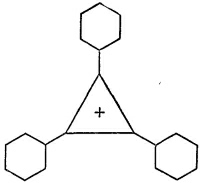 И действительно, оказывается, что нейтральную молекулу трифенилциклопропанила сделать очень трудно, но зато сравнительно легко соорудить положительный ион, показанный на фиг. 13.16. Правда, кольцо из трех атомов никогда не бывает легко сделать, потому что, когда связи в органической молекуле образуют равносторонний треугольник, всегда появляются большие напряжения. Чтобы соединение было устойчиво, структуру нужно как-то стабилизировать. Оказывается, что, если поставить по углам три бензольных кольца, можно сделать положительный ион. (Отчего нужно добавлять бензольные кольца, непонятно.) И действительно, оказывается, что нейтральную молекулу трифенилциклопропанила сделать очень трудно, но зато сравнительно легко соорудить положительный ион, показанный на фиг. 13.16. Правда, кольцо из трех атомов никогда не бывает легко сделать, потому что, когда связи в органической молекуле образуют равносторонний треугольник, всегда появляются большие напряжения. Чтобы соединение было устойчиво, структуру нужно как-то стабилизировать. Оказывается, что, если поставить по углам три бензольных кольца, можно сделать положительный ион. (Отчего нужно добавлять бензольные кольца, непонятно.)
Подобным же образом можно также проанализировать и пятиугольное кольцо. Если вы начертите энергетическую диаграмму, то качественно сможете убедиться, что шестиэлектронная структура должна быть особо устойчива, так что такая молекула должна быть устойчивее всего в виде отрицательного иона. И вот кольцо из пяти атомов действительно хорошо известно, легко сооружается и действует всегда как отрицательный ион. Подобным же образом вы легко убедитесь, что кольцо из 4 и 8 атомов не очень интересно, а кольцо из 14 или 10 (как и кольцо из 6) должно быть особенно устойчиво в форме нейтрального объекта.
СМОТРИТЕ ТАКЖЕ:
Социальные комментарии Cackle
|




 Можно ли применить все эти идеи для изучения других молекул? Рассмотрим такую молекулу, как бутадиен (1,3); она показана на фиг. 13.9 с помощью обычной картины валентных связей.
Можно ли применить все эти идеи для изучения других молекул? Рассмотрим такую молекулу, как бутадиен (1,3); она показана на фиг. 13.9 с помощью обычной картины валентных связей. Мы можем опять затеять то же игры с лишней четверкой электронов, отвечающей двум двойным связям. Если ее убрать, то остается четыре атома углерода по одной линии. А как рассчитывать такую линию, вы уже знаете. «Но позвольте,— скажете вы,—я ведь только знаю, как решать бесконечную линию». Однако решения для бесконечной линии включают также и решения для конечной. Следите. Пусть N — число атомов на прямой; пронумеруем их 1, 2, ..., N (фиг. 13.10). В уравнении для амплитуды в точке 1 у вас не появится член для перехода из точки 0. Точно так же уравнение для точки N будет отличаться от того, которым мы пользовались для бесконечной прямой, потому что никакого вклада точки N + 1 не будет. Но представьте, что мы придумали решение для бесконечной прямой со следующим свойством: амплитуда оказаться вблизи атома 0 есть нуль и амплитуда оказаться вблизи атома N + 1 тоже нуль. Тогда система уравнений для всех точек от 1 до N на конечной линии также будет удовлетворяться. Казалось бы, таких решений не бывает, ибо все наши решения имеют вид е¡kxn и обладают всюду одинаковой абсолютной величиной. Но вспомните, что энергия зависит только от абсолютной величины k, так что другим в равной мере законным решением было бы е–¡kxn. И то же справедливо для любой суперпозиции этих двух решений. Вычитая их, мы получим решение sin kхn, а оно удовлетворяет требованию, чтобы амплитуда при х = 0 была нулем. И оно все еще соответствует энергии Е0 — 2А cos kb. Далее, подходящим выбором величины k можно также добиться, чтобы амплитуда в xN+1 была тоже нулем. Для этого нужно, чтобы (N + 1) кb было кратным π, т. е. чтобы
Мы можем опять затеять то же игры с лишней четверкой электронов, отвечающей двум двойным связям. Если ее убрать, то остается четыре атома углерода по одной линии. А как рассчитывать такую линию, вы уже знаете. «Но позвольте,— скажете вы,—я ведь только знаю, как решать бесконечную линию». Однако решения для бесконечной линии включают также и решения для конечной. Следите. Пусть N — число атомов на прямой; пронумеруем их 1, 2, ..., N (фиг. 13.10). В уравнении для амплитуды в точке 1 у вас не появится член для перехода из точки 0. Точно так же уравнение для точки N будет отличаться от того, которым мы пользовались для бесконечной прямой, потому что никакого вклада точки N + 1 не будет. Но представьте, что мы придумали решение для бесконечной прямой со следующим свойством: амплитуда оказаться вблизи атома 0 есть нуль и амплитуда оказаться вблизи атома N + 1 тоже нуль. Тогда система уравнений для всех точек от 1 до N на конечной линии также будет удовлетворяться. Казалось бы, таких решений не бывает, ибо все наши решения имеют вид е¡kxn и обладают всюду одинаковой абсолютной величиной. Но вспомните, что энергия зависит только от абсолютной величины k, так что другим в равной мере законным решением было бы е–¡kxn. И то же справедливо для любой суперпозиции этих двух решений. Вычитая их, мы получим решение sin kхn, а оно удовлетворяет требованию, чтобы амплитуда при х = 0 была нулем. И оно все еще соответствует энергии Е0 — 2А cos kb. Далее, подходящим выбором величины k можно также добиться, чтобы амплитуда в xN+1 была тоже нулем. Для этого нужно, чтобы (N + 1) кb было кратным π, т. е. чтобы
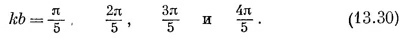
 Это выглядит вполне разумно. Энергия чуть пониже, чем просто у двух двойных связей, но связь не так сильна, как в бензоле. Во всяком случав, именно так химик анализирует некоторые органические молекулы.
Это выглядит вполне разумно. Энергия чуть пониже, чем просто у двух двойных связей, но связь не так сильна, как в бензоле. Во всяком случав, именно так химик анализирует некоторые органические молекулы. В органической химии при работе с подобного рода теорией используют еще одну идею. Она, пожалуй, самая удачная из всех (или по крайней мере в определенном смысле самая точная). Она отвечает на такой вопрос: в каких случаях получается особенно прочная химическая связь? Ответ очень интересен. Возьмем вначале для примера бензол и представим ряд событий, которые произойдут, если мы начнем с шестикратно ионизованной молекулы и примемся добавлять новые и новые электроны. Тогда нужно будет говорить о различных ионах бензола — отрицательных и положительных. Изобразим энергию иона (или нейтральной молекулы) как функцию числа электронов. Если мы примем Е0 = 0 (мы не знаем, чему равно Е0), то получим кривую, показанную на фиг. 13.13. Для первых двух электронов наклон функции постоянен — это прямая линия. Затем для каждой очередной группы электронов он возрастает, меняясь скачком от одной группы к другой. Наклон изменяется тогда, когда заканчивается заполнение системы уровней с одной энергией и очередному электрону приходится переходить к очередной более высокой системе уровней.
В органической химии при работе с подобного рода теорией используют еще одну идею. Она, пожалуй, самая удачная из всех (или по крайней мере в определенном смысле самая точная). Она отвечает на такой вопрос: в каких случаях получается особенно прочная химическая связь? Ответ очень интересен. Возьмем вначале для примера бензол и представим ряд событий, которые произойдут, если мы начнем с шестикратно ионизованной молекулы и примемся добавлять новые и новые электроны. Тогда нужно будет говорить о различных ионах бензола — отрицательных и положительных. Изобразим энергию иона (или нейтральной молекулы) как функцию числа электронов. Если мы примем Е0 = 0 (мы не знаем, чему равно Е0), то получим кривую, показанную на фиг. 13.13. Для первых двух электронов наклон функции постоянен — это прямая линия. Затем для каждой очередной группы электронов он возрастает, меняясь скачком от одной группы к другой. Наклон изменяется тогда, когда заканчивается заполнение системы уровней с одной энергией и очередному электрону приходится переходить к очередной более высокой системе уровней. В действительности истинная энергия иона бензола совершенно непохожа на фиг. 13.13 из-за взаимодействий электронов и из-за электростатических энергий, которыми мы пренебрегли. Эти поправки, однако,.меняются с n довольно плавно. Даже если бы их все учесть, на окончательной энергетической кривой все равно остались бы изломы при таких n, при которых как раз заполняются отдельные уровни энергии.
В действительности истинная энергия иона бензола совершенно непохожа на фиг. 13.13 из-за взаимодействий электронов и из-за электростатических энергий, которыми мы пренебрегли. Эти поправки, однако,.меняются с n довольно плавно. Даже если бы их все учесть, на окончательной энергетической кривой все равно остались бы изломы при таких n, при которых как раз заполняются отдельные уровни энергии. Эта теория объяснила и предсказала некоторые весьма необычные химические факты. Вот очень простой пример. Возьмем кольцо из трех атомов. Почти невозможно поверить, что химик сможет из трех атомов составить кольцо и сделать его устойчивым. Но это было сделано. Энергетический круг для трех электронов показан на фиг. 13.15. Если поместить в нижнее состояние два электрона, то пойдут в дело только два из трех требуемых электронов. Третий электрон придется поместить на более высокий уровень. Отсюда следует, что молекула не будет слишком устойчивой. Зато двухэлектронная структура обязана быть устойчивой.
Эта теория объяснила и предсказала некоторые весьма необычные химические факты. Вот очень простой пример. Возьмем кольцо из трех атомов. Почти невозможно поверить, что химик сможет из трех атомов составить кольцо и сделать его устойчивым. Но это было сделано. Энергетический круг для трех электронов показан на фиг. 13.15. Если поместить в нижнее состояние два электрона, то пойдут в дело только два из трех требуемых электронов. Третий электрон придется поместить на более высокий уровень. Отсюда следует, что молекула не будет слишком устойчивой. Зато двухэлектронная структура обязана быть устойчивой. И действительно, оказывается, что нейтральную молекулу трифенилциклопропанила сделать очень трудно, но зато сравнительно легко соорудить положительный ион, показанный на фиг. 13.16. Правда, кольцо из трех атомов никогда не бывает легко сделать, потому что, когда связи в органической молекуле образуют равносторонний треугольник, всегда появляются большие напряжения. Чтобы соединение было устойчиво, структуру нужно как-то стабилизировать. Оказывается, что, если поставить по углам три бензольных кольца, можно сделать положительный ион. (Отчего нужно добавлять бензольные кольца, непонятно.)
И действительно, оказывается, что нейтральную молекулу трифенилциклопропанила сделать очень трудно, но зато сравнительно легко соорудить положительный ион, показанный на фиг. 13.16. Правда, кольцо из трех атомов никогда не бывает легко сделать, потому что, когда связи в органической молекуле образуют равносторонний треугольник, всегда появляются большие напряжения. Чтобы соединение было устойчиво, структуру нужно как-то стабилизировать. Оказывается, что, если поставить по углам три бензольных кольца, можно сделать положительный ион. (Отчего нужно добавлять бензольные кольца, непонятно.)