| Обучение и материалы |
|---|
| Физический справочник |
| Формулы по физике |
| Шпаргалки по физике |
| Энциклопедия |
| Репетиторы по физике |
| Работа для физиков |
| Быстрый устный счет |
| Виртуальные лабораторные |
| Опыты по физике |
| ЕГЭ онлайн |
| Онлайн тестирование |
| Ученые физики |
| Необъяснимые явления |
| Ваша реклама на сайте |
| Разное |
| Контакты |
| Спецкурс |
|---|
| Фейнмановские лекции |
|
В мире больших скоростей |
Введение в теорию относительности |
|
Лекции по биофизике |
| Лекции по ядерной физике |
| Ускорение времени... |
| Лазеры |
| Нанотехнологии |
| Книги |
| полезное |
|---|
| Смешные анекдоты о физике
Готовые шпоры по физике Физика в жизни Ученые и деньги Нобелевские лауреаты Фото Видео Карта сайта |
| На заметку |
|---|
| Если вам понравился сайт, предлагаем разместить нашу кнопку |
| Дополнительно |
|---|
|
Компьютерные программы по физике 
Физика и юмор 
Онлайн тестирование по физике 
|
Бойля точкаБойля точка, точка минимума на изотерме реального газа в координатах p—pV (рис.; р — давление газа, V — занимаемый газом объём); названа в честь английского учёного Р. Бойля (R. Boyle). Вблизи Бойля точки небольшие участки изотерм реального газа можно приближённо рассматривать как отрезки горизонтальных прямых, представляющих, согласно Клапейрона уравнению pV=(M/μ)RT, изотермы идеального газа (R — газовая постоянная, М — масса газа, μ — молярная масса). Иными словами, Бойля точка определяет температуру, при которой для данного реального газа применимо уравнение идеального газа. Участок изотермы аb (слева от Бойля точки) соответствует условиям, когда реальный газ более сжимаем, чем идеальный; участок be (справа от Бойля точки) соответствует условиям меньшей сжимаемости реального газа по сравнению с идеальным. Слева от Бойля точки сказывается преобладающее влияние сил притяжения между молекулами, облегчающих сжатие газа, справа от Бойля точки — влияние собственного объёма молекул, препятствующего сжатию. Вблизи Бойля точки эти факторы, отличающие реальный газ от идеального, взаимно компенсируются.
Линия, соединяющая Бойля точки изотерм, называется кривой Бойля. Точка этой кривой, лежащая на оси ординат, определяет т. н. температуру Бойля ТB. Для газа, подчиняющегося Ван-дер-Ваальса уравнению, ТB=3,375 Тк, где Тк— критическая температура, При Т<Тk возможно полное сжижение газа под давлением, при Т<Тк возможно частичное сжижение газов при дросселировании (см. Джоуля-Томсона эффект). |
© All-Физика, 2009-2026
При использовании материалов сайта ссылка на www.all-fizika.com обязательна.
При использовании материалов сайта ссылка на www.all-fizika.com обязательна.

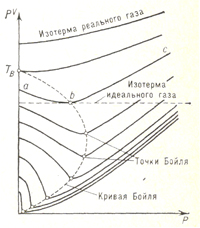 Изотермы реального газа в координатах р—pV. На изотермах с температурой T>TB точки Бойля отсутствуют.
Изотермы реального газа в координатах р—pV. На изотермах с температурой T>TB точки Бойля отсутствуют.