| Обучение и материалы |
|---|
| Физический справочник |
| Формулы по физике |
| Шпаргалки по физике |
| Энциклопедия |
| Репетиторы по физике |
| Работа для физиков |
| Быстрый устный счет |
| Виртуальные лабораторные |
| Опыты по физике |
| ЕГЭ онлайн |
| Онлайн тестирование |
| Ученые физики |
| Необъяснимые явления |
| Ваша реклама на сайте |
| Разное |
| Контакты |
| Спецкурс |
|---|
| Фейнмановские лекции |
|
В мире больших скоростей |
Введение в теорию относительности |
|
Лекции по биофизике |
| Лекции по ядерной физике |
| Ускорение времени... |
| Лазеры |
| Нанотехнологии |
| Книги |
| полезное |
|---|
| Смешные анекдоты о физике
Готовые шпоры по физике Физика в жизни Ученые и деньги Нобелевские лауреаты Фото Видео Карта сайта |
| На заметку |
|---|
| Если вам понравился сайт, предлагаем разместить нашу кнопку |
| Дополнительно |
|---|
|
Компьютерные программы по физике 
Физика и юмор 
Онлайн тестирование по физике 
|
Удельные теплоемкости газов
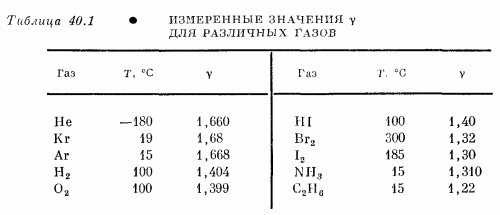
Посмотрим теперь, как можно проверить теорию и оценить, насколько хороша классическая теория газов. Мы уже говорили, что если U —внутренняя энергия N молекул, то формула pV = NkT = (γ—1)U иногда и для некоторых газов может оказаться правильной. Мы знаем, что для одноатомного газа правая часть равна 2/3 кинетической энергии движения центров масс атомов. В случае одноатомного газа кинетическая энергия равна внутренней энергии, поэтому γ—1 = 2/3. Но предположим, что мы столкнулись с более сложной молекулой, которая может вращаться и колебаться, и предположим (в классической механике это так), что энергии внутренних движений также пропорциональны kТ. Поэтому при заданной температуре молекула, кроме кинетической энергии kТ, имеет внутреннюю энергию колебания и вращения. Тогда полная энергия U включает не только кинетическую энергию, но и вращательную энергию и мы получаем другие значения γ. Наилучший способ измерения γ —это измерение удельной теплоемкости, характеризующей изменение энергии при изменении температуры. К этому способу мы еще вернемся, а пока предположим, что нам удалось экспериментально определить γ с помощью кривой PVγ , соответствующей адиабатическому сжатию. Попробуем вычислить γ для ряда частных случаев. Прежде всего для одноатомных газов полная энергия U есть не что иное, как кинетическая энергия, и в этом случае, как мы уже знаем, γ равно 5/3. В качестве примера двухатомных газов рассмотрим кислород, водород, пары иода и т. д. и предположим, что двухатомный газ можно представить как собрание пар атомов, между которыми действуют силы, похожие на те, что изображены на фиг. 40.3. Можно также предположить, и оказывается, что это вполне законно, что при температурах, обычных для диатомных газов, пары атомов стремятся удалиться друг от друга на расстояние r0 (расстояние минимума потенциальной энергии). Если бы это было не так, и вероятность не очень сильно зависела от удаления от равновесной конфигурации, то мы обнаружили бы, что кислород есть смесь сравнимых количеств О2 и одиночных атомов кислорода. А мы знаем, что в кислороде присутствует очень мало одиночных атомов кислорода, а это означает, что глубина потенциальной ямы значительно больше kТ, и это как раз мы и предполагали. Но раз атомы, составляющие молекулу, прочно закреплены на расстоянии r0, то нам понадобится , лишь часть потенциальной кривой вблизи минимума, которую в этом случае можно приближенно заменить параболой. Параболический потенциал соответствует гармоническому осциллятору, и, в самом деле, отличной моделью молекулы кислорода могут служить два соединенных пружинкой атома. Но чему же равна полная энергия молекулы при температуре Т? Мы знаем, что кинетическая энергия каждого из атомов равна 3/2 kТ, так что кинетическая энергия обоих атомов равна 3/2kТ + 3/2kТ. Можно распределить эту энергию иначе: тогда те же самые 3/2 плюс 3/2 будут выглядеть как кинетическая энергия центра масс (3/2), кинетическая энергия вращения (2/2) и кинетическая энергия колебаний (1/2). Известно, что на долю кинетической энергии колебаний приходится 1/2, потому что это одномерное движение, а каждой степени свободы соответствует 1/2kТ. Обращаясь к вращениям, мы можем выделить две оси вращения, что соответствует двум независимым движениям. Мы представляем себе атомы в виде точек, которые не могут вращаться вокруг соединяющей их линии. Но на всякий случай запомним о таком предположении, потому что если мы упремся где-то в тупик, то, может быть, здесь обнаружится корень зла. Нас должен интересовать еще и другой вопрос: чему равна потенциальная энергия колебаний, велика ли она? Средняя потенциальная энергия гармонического осциллятора равна средней кинетической энергии, т.е. также 1/2kТ. Полная энергия молекулы U = 7/2kТ, или kТ = 2/7U на атом. Это означает, что γ равно 9/7, а не 5/3, т. е. γ = 1,286. Можно сравнить эти числа с действительно измеренными значениями γ, приведенными в табл. 40.1. Взгляните сначала на гелий; это одноатомный газ, и значение γ очень близко к 5/3; отклонение от этого значения, вероятно, есть просто следствие экспериментальных неточностей, хотя при столь низких температурах между атомами могут появиться силы взаимодействия. Криптон и аргон —еще два одноатомных газа —также дают согласующиеся значения в пределах ошибки эксперимента.
Перейдем к двухатомным газам. Тут же обнаружится, что значение γ для водорода, равное 1,404, не согласуется с теоретическим значением 1,286. Очень близкое значение дает и кислород, 1,399, но с теоретическим это снова не согласуется. Для йодистого водорода γ равно просто 1,40. Начинает казаться, что мы нашли общий закон: для двухатомных молекул γ равно 1,40. Но нет, поглядите дальше. Для брома мы получаем 1,32, а для иода 1,30. Поскольку 1,30 довольно близко к 1,286, то можно считать, что экспериментальное значение γ для иода согласуется с теоретическим, а кислород представляет собой исключение. Это уже неприятно. То, что верно для одной молекулы, неверно для другой, и нам, по-видимому, надо проявить хитроумие, чтобы объяснить это. Давайте рассмотрим еще более сложные молекулы, состоящие из большого числа частей, например С2Н6 — этан. Молекула атома состоит из восьми разных атомов, и все они качаются и вращаются в самых разных комбинациях, так что полная величина внутренней энергии должна складываться из огромного числа kТ, по крайней мере 12 kТ только для одной кинетической энергии, поэтому γ–1 должно быть очень близко к нулю, а γ почти в точности равно единице. И действительно, значение γ для этана меньше, чем в предыдущих случаях, но 1,22 — не так
СМОТРИТЕ ТАКЖЕ:Социальные комментарии Cackle |
При использовании материалов сайта ссылка на www.all-fizika.com обязательна.

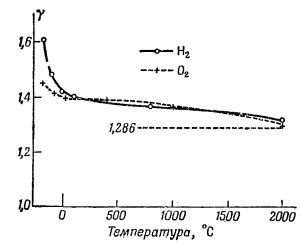 Ну а дальше совсем плохо, ибо двухатомную молекулу нельзя рассматривать как абсолютно жесткую, даже в пределе. Даже если связь между атомами так сильна, что они не могут и пошевелиться, все равно нужно считать, что они колеблются. Колебательная энергия всегда равна kТ, поскольку она не зависит от силы связи. Но если представить себе двухатомную молекулу абсолютно жесткой, остановить колебания и выбросить эту степень свободы, то мы получим U = 5/2 kТ и γ = 1,40 для двухатомных газов. Казалось бы, это подходит и для Н2, и для О2. Но вопрос по-прежнему остается открытым, потому что γ и для кислорода, и для водорода зависит от температуры! На фиг. 40.6 показаны результаты нескольких измерений. Для Н2 значение γ изменяется от 1,6 при —185° С до 1,3 при 2000° С. В случае водорода изменения γ еще больше, но и в случае кислорода γ явно стремится возрасти при падении температуры.
Ну а дальше совсем плохо, ибо двухатомную молекулу нельзя рассматривать как абсолютно жесткую, даже в пределе. Даже если связь между атомами так сильна, что они не могут и пошевелиться, все равно нужно считать, что они колеблются. Колебательная энергия всегда равна kТ, поскольку она не зависит от силы связи. Но если представить себе двухатомную молекулу абсолютно жесткой, остановить колебания и выбросить эту степень свободы, то мы получим U = 5/2 kТ и γ = 1,40 для двухатомных газов. Казалось бы, это подходит и для Н2, и для О2. Но вопрос по-прежнему остается открытым, потому что γ и для кислорода, и для водорода зависит от температуры! На фиг. 40.6 показаны результаты нескольких измерений. Для Н2 значение γ изменяется от 1,6 при —185° С до 1,3 при 2000° С. В случае водорода изменения γ еще больше, но и в случае кислорода γ явно стремится возрасти при падении температуры.