| Обучение и материалы |
|---|
| Физический справочник |
| Формулы по физике |
| Шпаргалки по физике |
| Энциклопедия |
| Репетиторы по физике |
| Работа для физиков |
| Быстрый устный счет |
| Виртуальные лабораторные |
| Опыты по физике |
| ЕГЭ онлайн |
| Онлайн тестирование |
| Ученые физики |
| Необъяснимые явления |
| Ваша реклама на сайте |
| Разное |
| Контакты |
| Спецкурс |
|---|
| Фейнмановские лекции |
|
В мире больших скоростей |
Введение в теорию относительности |
|
Лекции по биофизике |
| Лекции по ядерной физике |
| Ускорение времени... |
| Лазеры |
| Нанотехнологии |
| Книги |
| полезное |
|---|
| Смешные анекдоты о физике
Готовые шпоры по физике Физика в жизни Ученые и деньги Нобелевские лауреаты Фото Видео Карта сайта |
| На заметку |
|---|
| Если вам понравился сайт, предлагаем разместить нашу кнопку |
| Дополнительно |
|---|
|
Компьютерные программы по физике 
Физика и юмор 
Онлайн тестирование по физике 
|
Принцип неопределенности
Понятия вероятности оказались очень полезны при описании поведения газа, состоящего из огромного количества молекул. Немыслимо же в самом деле пытаться определить положение и скорость каждой из 1022 молекул! Когда впервые теория вероятности была применена к таким явлениям, то это рассматривалось просто как удобный способ работы в столь сложной обстановке. Однако теперь мы полагаем, что вероятность существенно необходима для описания различных атомных процессов. Согласно квантовой механике, этой математической теории малых частичек, при определении положения частички и ее скорости всегда существует некоторая неопределенность. В лучшем случае мы можем только сказать, что существует какая-то вероятность того, что частица находится вблизи точки х.
Один из основных результатов квантовой механики состоит в том, что эти две плотности p1(x) и р2(v) не могут быть выбраны независимо в том смысле, что они обе не могут быть сколь угодно узкими. Если мы возьмем «полуширины» кривых p1(x) и р2(v) и обозначим их соответственно [Δx] и [Δv] (см. фиг. 6.10), то природа требует, чтобы произведение этих двух полуширин было не меньше величины h/m, где m— масса частицы, a h — некоторая фундаментальная физическая постоянная, называемая постоянной Планка. Это соотношение записывается следующим образом:
и называется принципом неопределенности Гейзенберга. Чтобы это соотношение выполнялось, частица должна себя вести очень курьезно. Вы видите, что правая часть соотношения (6.22) постоянна, а это означает, что если мы попытаемся «приколоть» частицу в каком-то определенном месте, то эта попытка окончится тем, что мы не сможем угадать, куда она летит и с какой скоростью. Точно также если мы попытаемся заставить частицу двигаться очень медленно или с какой-то определенной скоростью, то она будет «расплываться», и мы не сможем точно указать, где она находится. Принцип неопределенности выражает ту неясность, которая должна существовать при любой попытке описания природы. Наиболее точное и полное описание природы должно быть только вероятностным. Однако некоторым физикам такой способ описания приходится не по душе. Им кажется, что о реальном поведении частицы можно говорить только, когда одновременно заданы импульсы и координаты. В свое время на заре развития квантовой механики эта проблема очень сильно волновала Эйнштейна. Он часто качал головой и говорил: «Но ведь не гадает же господь бог «орел — решка», чтобы решить, куда должен двигаться электрон!» Этот вопрос беспокоил его в течение очень долгого времени, и до конца своих дней он, по-видимому, так и не смог примириться с тем фактом, что вероятностное описание природы — это максимум того, на что мы пока способны. Есть физики, которые интуитивно чувствуют, что наш мир можно описать как-то по-другому, что можно исключить эти неопределенности в поведении частиц. Они продолжают работать над этой проблемой, но до сих пор ни один из них не добился сколько-нибудь существенного результата. Эта присущая миру неопределенность в определении положения частицы является наиболее важной чертой описания структуры атомов. В атоме водорода, например, который состоит из одного протона, образующего ядро, и электрона, находящегося где-то вне его, неопределенность в местонахождении электрона такая же, как и размеры самого атома! Мы не можем поэтому с уверенностью сказать, где, в какой части атома находится наш электрон, и уж, конечно, не может быть и речи ни о каких «орбитах». С уверенностью можно говорить только о вероятности p(r)ΔV обнаружить электрон в элементе объема ΔV на расстоянии r от протона. Квантовая механика позволяет в этом случае вычислять плотности вероятности р(r), которая для невозмущенного атома водорода равна Ae-r2/α2. Это — колоколообразная функция наподобие изображенной на фиг. 6.8, причем число а представляет собой характерную величину радиуса, после которого функция очень быстро убывает. Несмотря на то что существует вероятность (хотя и небольшая) обнаружить электрон на большем, чем а, расстоянии от ядра, мы называем эту величину «радиусом атома». Она равна приблизительно 10-10м. Если вы хотите как-то представить себе атом водорода, то вообразите этакое «облако», плотность которого пропорциональна плотности вероятности. Пример такого облака показан на фиг. 6.11. Такая наглядная картинка, пожалуй, наиболее близка к истине, хотя тут же нужно помнить, что это не реальное «электронное облако», а только «облако вероятностей». Где-то внутри него находится электрон, но природа позволяет нам только гадать, где же именно он находится.
В своем стремлении узнать о природе вещей как можно больше современная физика обнаружила, что существуют вещи, познать которые точно ей никогда не удастся. Многому из наших знаний суждено навсегда остаться неопределенным. Нам дано знать только вероятности. СМОТРИТЕ ТАКЖЕ:Социальные комментарии Cackle |
При использовании материалов сайта ссылка на www.all-fizika.com обязательна.

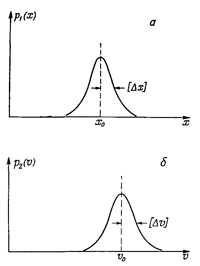 Для описания местоположения частицы можно ввести плотность вероятности p1(x), так что p1(x)Δx будет вероятностью того, что частица находится где-то между х и х + Δx. Если положение частицы установлено достаточно хорошо, то примерный вид функции p1(x) может иллюстрировать график, приведенный на фиг. 6.10, а. Точно такое же положение и со скоростью частицы: она тоже неизвестна нам точно. С некоторой вероятностью р2 (v)Δv частица может двигаться со скоростью, находящейся в интервале между v и v + Δv.
Для описания местоположения частицы можно ввести плотность вероятности p1(x), так что p1(x)Δx будет вероятностью того, что частица находится где-то между х и х + Δx. Если положение частицы установлено достаточно хорошо, то примерный вид функции p1(x) может иллюстрировать график, приведенный на фиг. 6.10, а. Точно такое же положение и со скоростью частицы: она тоже неизвестна нам точно. С некоторой вероятностью р2 (v)Δv частица может двигаться со скоростью, находящейся в интервале между v и v + Δv.
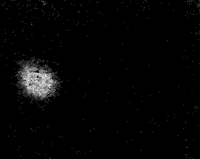 Воображаемый атом водорода.
Воображаемый атом водорода.